原肌球蛋白受体激酶(TRK)家族属于受体酪氨酸激酶,主要参与神经组织的发育和功能调控。TRKs包括TRKA、TRKB和TRKC三个亚型,分别由NTRK1、NTRK2和NTRK3基因编码。到目前为止,已经被发现并报道的NTRK基因畸变有染色体易位、基因扩增、点突变和选择性剪接等,这些变化会导致TRK通路组成型激活,促进细胞增殖、存活和恶性转化。在TRK激活的不同分子机制中,NTRK基因的染色体易位研究最为频繁,比较典型的是由于染色体异位重排引起的NTRK基因的3'区域与伴侣基因的5'区域相连,最终导致TRK激酶磷酸化并激活下游信号通路,从而调控细胞的生长、分化、凋亡等过程。至今,TRK融合已经被发现存在于许多人类恶性肿瘤中,包括肺癌、结直肠癌和软组织肉瘤等,这其中,TMP3-TRKA是最常见的融合之一。此外,TRK融合似乎是一些罕见癌症的主要促癌因素,如婴儿纤维肉瘤、分泌性乳腺癌、和类似乳腺的分泌性癌(MASC)。

图1几种常见的TRK抑制剂
经过科研人员长期的努力,目前已经有两种TRK抑制剂(图1-A1:larotrectinib(拉罗替尼);图1-A2:entrectinib(恩曲替尼))被FDA批准用于部分携带NTRK融合基因的癌症病人的治疗,虽然这两种药均表现出了不错的临床效果,但同时也产生了一些不良反应,如头晕、感觉异常、体重增加等,其中的一些不良反应被认为是药物抑制了大脑中的野生型TRK信号导致的结果。此外,据报道,病人在使用这些药物后产生了耐药性,因此,研究者们渴望开发一种新的药物作用机制来更持久地抑制TRK通路,同时减少不良反应。
近年来,使用降解剂对目标蛋白水平进行化学下调以此来治疗疾病的策略已经成为研究的热点,许多降解剂已显示出了超过酶抑制剂的优势,因为它们不仅会抑制靶蛋白的酶活性,而且会耗尽靶蛋白的骨架和其他非催化功能,此外,由于降解剂的催化性质,可以避免高暴露量,从而改善潜在的不利影响。2019年,研究者们报道了一种野生型TRKC降解剂,它能够在胞外域结合野生型TRKC并达到降解蛋白的目的。但显然,只针对胞外结构域的TRK降解剂在治疗癌症中的应用是有限的。最近,本研究论文的作者们在类似物3和广谱TRK抑制剂4(GNF-8625)的基础上,设计并合成一系列TRK降解剂,通过构效关系研究确定了两种靶向激酶胞内结构域的高效选择性降解剂5(CG416)和6(CG428)。
基于化合物3-TRKA结构域复合物的共晶结构与化合物3和GNF-8625的细胞活性数据(TRKAIC50= 3nM),研究者认为化合物3和GNF-8625都能有效地与TRKA结合,考虑到两者的分子量,最终选择化合物3为TRK结合部分来设计降解剂,为了便于合成,在吡啶的2号位引入哌嗪以便后续的连接,选择pomalidomide作为E3连接酶配体,因其相比于VHL具有更小的分子量和潜在更优的PK性质。

图2化合物合成
在上述基础上,研究者们设计合成了带有各种碳链连接子或聚乙二醇(PEG)连接子的降解剂(图2),并进行了SAR研究(图3):

图3含不同连接子降解剂的SAR研究
在KM12细胞系中的实验数据显示(图3),用10nM浓度降解剂处理6小时后,上述合成的所有化合物都能显著降低TPM3-TRKA水平。当降解剂浓度降低至1nM甚至是0.1nM,化合物6表现出相比其它化合物更优异的降解效果,此外,化合物5和6在结构上相似,仅仅只有一个原子的差异,选择这两个化合物进行进一步的生物学表征有助于研究降解剂微妙的结构变化与其降解效力之间的关系。

图4化合物5和6对TRKs的亲和力实验
对抑制剂GNF-8625、降解剂5和6及其对照化合物25和26与TRKA、TRKB和TRKC的亲和力进行评估发现,与GNF-8625相比,降解剂5和6对TRKs的亲和力略有下降,而在降解剂5和6末端的pomalidomide上引入甲基对亲和力没有太大的影响(图4)。实验结果表明,对GNF-8625溶剂暴露区域的结构进行修饰改造总体是可行的。

图5化合物5和6的TRK降解能力实验
在KM12细胞系中对化合物5和6的测试结果表明(图5),两种化合物在较低浓度时均能明显下调TPM3-TRKA水平,同时抑制下游PLCγ-1磷酸化,而PLCγ-1蛋白水平不受影响,这说明降解剂对PLCγ-1蛋白磷酸化的抑制效果并不是通过下调PLCγ-1蛋白水平实现的(图5-A)。进一步的动力学实验显示,这两种化合物均在0.3h内就能明显地观察到对TPM3-TRKA蛋白的降解效果以及对PLC的磷酸化抑制效果(图5-B)。此外,在HEL细胞系中,化合物5和6都显示出了高效降解野生型TRKA的能力(图5-C),相反,对照化合物25和26在30nM时依然无法降解HEL细胞中的野生型TRKA。

图6化合物5和6的选择性实验
为了评估化合物5和6对TRK家族其它成员的降解效力,研究者们测试了两种化合物在KM12细胞系中分别对AGBL4-TRKB和ETV6-TRKC的降解效果(图6)。比较意外的是,与TRKB亲和力更弱的化合物5,反而表现出比化合物6更好的AGBL4-TRKB降解效果,这说明亲和力不是决定降解剂降解效力的唯一因素。总的来说,两种化合物对AGBL4-TRKB和ETV6-TRKC的降解效果均远不如对TPM3-TRKA的降解效果(图6A,Bvs 图5A),而且在降解剂浓度为500nM时,还观察到了钩状效应。

图7化合物5和6抑制细胞增殖实验
此外,相比GNF-8625和化合物25、26,化合物5和6抑制KM12细胞增殖的效果要好很多,其IC50值分别达到了5.4nM和2.9nM(图7)。

图8ICR小鼠实验
为了进一步考察化合物5和6的生物可利用性,该论文作者评价了两种分子在小鼠体内的PK性质(图8)。数据显示,在1h左右,两种化合物的血浆暴露量均达到峰值,分别约为2050nM(5)和1640nM(6),而且这两种化合物的血浆浓度在8h后依然远高于它们各自在KM12细胞中的DC50值(分别为0.48nM和0.36nM),最重要的是,在PK测试期间,没有观察到临床症状,这些结果均有助于进一步的体内研究。
基于GNF-8625类似物3与TRKA复合物的共晶结构,研究者们设计并合成了一系列具有不同连接子类型的可能的蛋白降解分子,通过SAR研究确定了两个降解效果优秀且结构相似的分子5和6。进一步的研究表明,5和6均表现出与TRKs较高的亲和性,并在KM12细胞中均以浓度和时间依赖的方式选择性下调TPM3-TRKA融合蛋白水平,而对AGBL4-TRKB和ETV6-TRKC这两种融合蛋白的降解效果较差。此外,化合物5和6均表现出了相比于GNF-8625更好的抗细胞增殖作用,在小鼠体内也都显示出良好的血浆暴露水平。
参考文献
LiqunChen, Yanke Chen, Chunyan Zhang, Bingyang Jiao, Sheng Liang, QiongTan, Hongyu Chai, Weihua Yu, Yongzheng Qian, Hui Yang, Wuyi Yao,Jianguo Yu, Ying Luo, Michael Plewe, Jialiang Wang, Xiao-Ran Han, andJing Liu Discovery of First-In-Class Potent and Selective Tropomyosin
ReceptorKinase Degraders Journalof Medicinal Chemistry(2020),Ahead of Print. DOI: 10.1021/acs.jmedchem.0c01342
[1]Molecular Pharmaceutics(2019),16(10),4313-4318.
注:文中图片均来源于参考文献
-
产品编号: 1020445
CAS: 13526-66-4
-
产品编号: 1053327
CAS: 923595-49-7
-
产品编号: 1067937
CAS: 298690-72-9
-
产品编号: 1118265
CAS: 260367-12-2
-
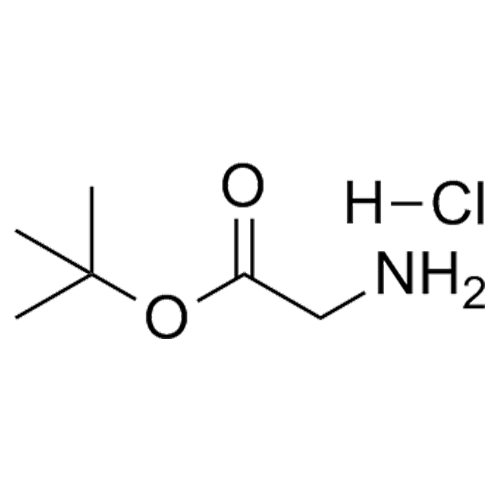
产品编号: 1028119
CAS: 27532-96-3
-

产品编号: 1036724
CAS: 58620-93-2
-
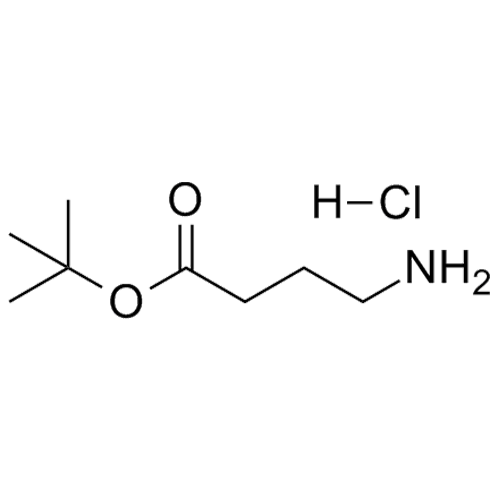
产品编号: 1063256
CAS: 58640-01-0
-

产品编号: 1067237
CAS: 5514-98-7
-
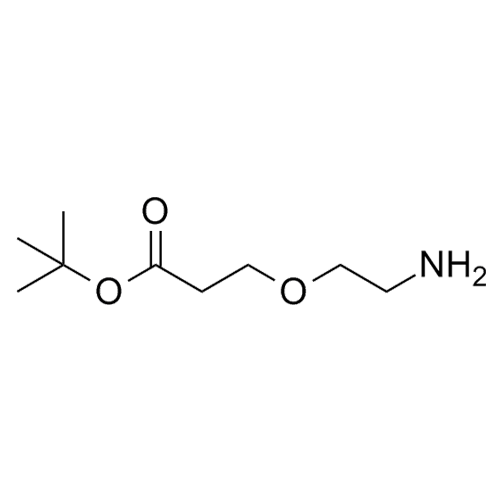
产品编号: 1129936
CAS: 1260092-46-3
-
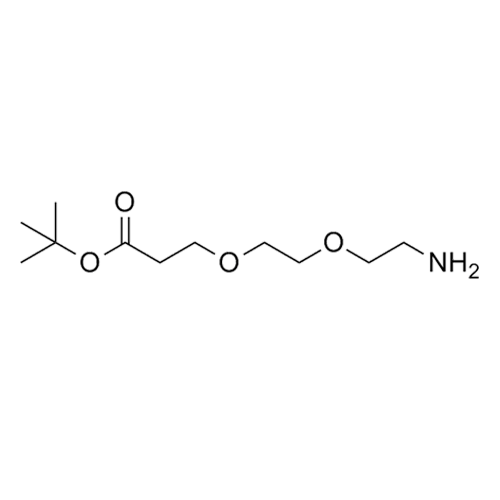
产品编号: 1105774
CAS: 756525-95-8
-
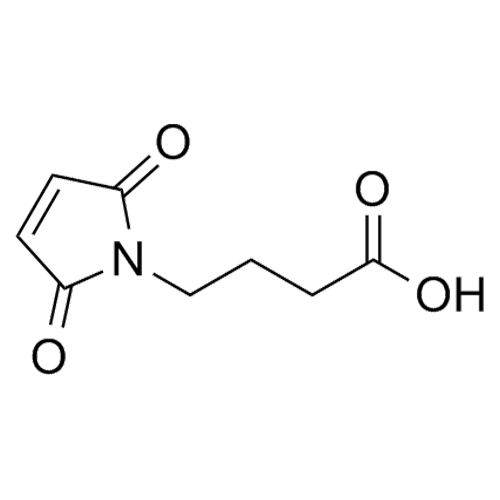
产品编号: 1164168
CAS: 57078-98-5
-

产品编号: 1035870
CAS: 55750-53-3
 技术支持
技术支持




 400-821-0725
400-821-0725





















 沪ICP备17019645号
沪ICP备17019645号







