ALK(AnaplasticLymphomaKinase,间变性淋巴瘤激酶)是一种受体酪氨酸激酶,属于胰岛素受体超家族。ALK高度保守,主要在成人脑组织中表达,对神经系统的发育起重要作用。1994年,科学家们首次在间变性大细胞非霍奇金淋巴瘤(ALCL)中发现了由染色体易位形成的(NPM)-ALK融合蛋白,随后,ALK与其他基因的融合被证实存在于ALCL、炎性肌纤维母细胞瘤、弥漫性大B细胞淋巴瘤、鳞状细胞癌和非小细胞肺癌中。除染色体易位之外,ALK基因扩增和野生型ALK蛋白的点突变激活也被报道存在于成神经细胞瘤、卵巢癌和炎性乳腺癌中,这使得ALK成为了各种含ALK融合的血液疾病和实体肿瘤治疗的一个有吸引力的靶点。
目前,已经上市和正处于临床试验阶段的ALK抑制剂有:克唑替尼(1,crizotinib)、色瑞替尼(2,ceritinib)、阿来替尼(3,alectinib)、布加替尼(4,brigatinib)、劳拉替尼(5,lorlatinib)、ASP3026(6)(图1)。
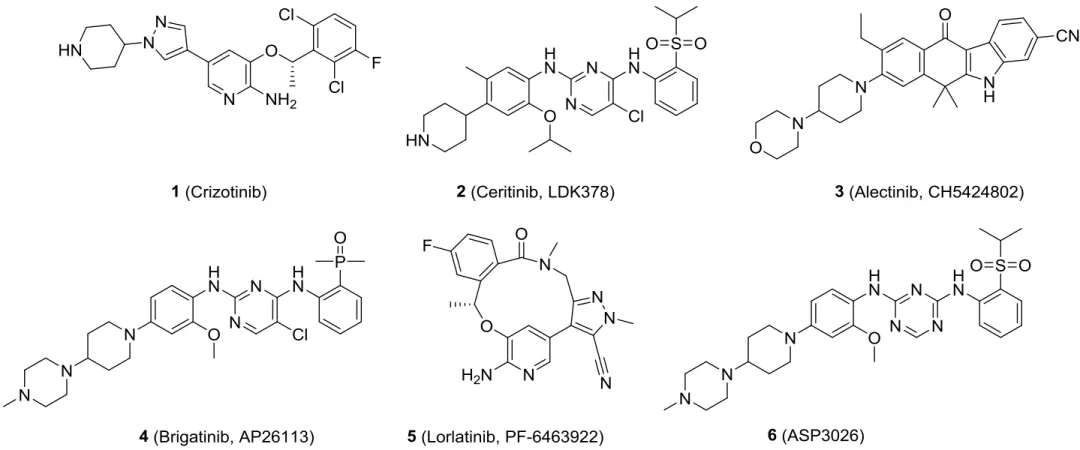
图1 已经上市和处于临床阶段的ALK抑制剂
其中,crizotinib是FDA批准的第一款ALK抑制剂,用于ALK阳性非小细胞肺癌(NSCLC)患者的临床治疗,但大部分患者在1~2年用药后容易产生耐药突变或转移导致病情恶化。随后,ceritinib、alectinib、brigatinib和lorlatinib先后获批用于晚期转移性的NSCLC治疗。ASP3026目前正处于临床试验中。
近期,王少萌团队发现了一种新的高效、口服活性的ALK抑制剂CJ-2360,它能有效抑制野生型ALK激酶和几种临床报道的ALK突变体,并能在ALK-阳性的KARPAS-299移植瘤模型中实现完全的肿瘤消退(图2)。
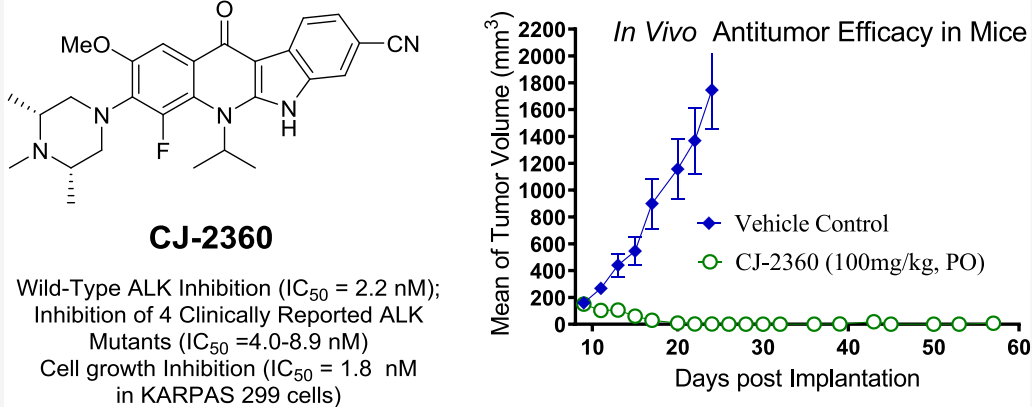
图2 CJ-2360的活性评估数据
在所有已获批上市或正处于临床阶段的ALK抑制剂中,alectinib是唯一一个具有四环并环结构的分子,并且其已被证明对ALK的选择性优于其他ALK抑制剂。因此,研究者选择alectinib作为设计新ALK抑制剂的模板。
为了保留四环并环的结构,研究者以吲唑并喹啉为主体骨架设计了化合物7a和7b(图3)。在体外酶活性实验中,7a即使浓度达到50μM也没有表现出抑制活性,而7b的IC50值为2.5μM。在alectinib结构中,羰基对面有两个甲基,研究者将7b相应位置的甲基替换成异丙基得到化合物7c,7c的IC50值达到28.6nM。进一步对7c的主要代谢位点进行改造,将4-吗啉基哌啶基替换成1-甲基哌嗪基得到了活性更好的化合物7d(图3)。

图3 化合物7a-7c的设计及活性数据
参照alectinib与ALK形成的复合物的共晶结构,研究者建立了化合物7d与ALK的结合模型(图4),两者有相似的结合模式,比较大的区别在于,alectinib的四环并环骨架上有一个乙基与ALK上的L1198、A1200和L1122残基存在疏水相互作用,而化合物7d在相同的位置上没有任何取代基。

图4 ALK分别与alectinib和化合物7d形成的复合物结构
如图4-B箭头所示,在化合物7d的1号位置上引入一个乙基得到化合物8b,其抑制活性相比7d有了10倍的提升(图5-8bvs7d),除了异丙基取代外,其它的烷基取代或溴取代均给出了不错的IC50值(图5-8a-8e)。研究者继而将烷基取代替换成烷氧基取代合成了化合物8f-8i,这些化合物对ALK的抑制能力都要优于7d。更重要的是,研究者在携带ALK融合蛋白的KARPAS-299细胞系中评估了上述化合物对细胞增殖的抑制活性,其效果相比7d均有较大提高。

图5 对化合物7d的1号位改造
如图4-B箭头所示,在化合物7d的2号位置上引入氟原子得到化合物9a,其对ALK的抑制能力与7d相差不大,但在KARPAS-299细胞系中,9a的活性比7d提高了10倍(图6)。以8f为模版化合物,在其2号位引入氟原子得到化合物9c,其细胞活性相比8f也有10倍的提升。这些数据表明,在苯环上引入氟原子可以显著提高化合物的细胞效力。

图6 对化合物7d的2号位改造
以化合物8f为模版,对喹啉氮上的取代基进行考察(图7),将异丙基替换成其它脂肪链如乙基、丙基、仲丁基或2-戊基得到化合物10a-10d,这些化合物对ALK的抑制活性相比8f均有不同程度的下降;将异丙基替换成环烷基,特别是环丁基、环戊基或环己基时,它们在KARPAS-299细胞系中表现出非常相似的细胞增殖抑制活性。

图7 对化合物8f的3号位改造
最后,研究者以9c为模版,考察了4号位不同增溶基对分子活性的影响(图8),最终得到活性最好的化合物CJ-2360,其不仅表现出很强的ALK抑制能力,在KARPAS-299细胞系中抑制细胞增殖的IC50值也达到了1.8nM。

图8 对化合物9c的4号位改造
在众多考察的化合物中,CJ-2360表现出了综合最好的酶活性和细胞活性,随后,研究者评估了CJ-2360分别在小鼠和大鼠体内的药代动力学参数(图9)。结果显示,在口服给药后,CJ-2360在小鼠体内达到了合理的口服暴露量,整体的口服生物利用度为38.2%,中等的血浆清除率(1.2L/h/kg),较大的容积分布(7.5L/kg)表明CJ-2360在小鼠组织分布广泛。在大鼠体内的药代动力学研究给出了相似的数据。

图9 CJ-2360在小鼠和大鼠体内的药代动力学参数
此外,研究者对携带KARPAS-299移植瘤的小鼠进行口服给药,并分析了CJ-2360在小鼠血浆和肿瘤组织中的药物浓度,证实CJ-2360在小鼠单次口服给药后便获得良好的血浆暴露量,而且其在肿瘤组织中的浓度要远大于在血浆中的浓度。
基于CJ-2360良好的体内药代动力学数据和肿瘤组织暴露量,研究者评估了其在携带KARPAS-299移植瘤小鼠体内的抗肿瘤效果,并以ceritinib作为阳性对照(图10)。数据显示,CJ-2360在每天两次给药后能够实现所有肿瘤完全消退,直到最后一次给药后的第23天肿瘤才开始恢复,证明CJ-2360在携带KARPAS-299移植瘤小鼠体内能够实现完全且持久的肿瘤消退,此外,小鼠对CJ-2360耐受性良好,在整个实验过程中没有引起体重减轻或其他毒性症状。作为对比,ceritinib只能实现部分肿瘤的完全消退。

图10 CJ-2360的体内抗肿瘤活性评估
临床中,部分ALK阳性肿瘤患者在经crizotinib治疗后,由于ALK突变而产生耐药性,目前已鉴定出几种临床ALK突变体。在ALK抑制剂的研发过程中,其对各种ALK突变体的抑制能力是必须考察的,因此,研究者对比了几种已经上市的ALK抑制剂和CJ-2360对ALK突变体的抑制活性(图11)。结果表明,CJ-2360对包括F1197M、G1269A、L1196M和S1206Y在内的ALK突变体也具有很高的抑制活性,分别达到了4.0、8.8、6.3和8.9nM。

图11 几种抑制剂对ALK野生型和突变体的抑制能力对比
研究者以alectinib为模板化合物,设计合成了一系列包含吲唑并喹啉骨架的新型ALK抑制剂,通过评估最终筛选出综合酶活性和细胞活性最好的化合物CJ-2360。CJ-2360有着良好的口服血浆暴露量、肿瘤组织浓度以及生物利用度,对野生型ALK和几种临床ALK突变体均有很高的抑制活性。最重要的是,体内抗肿瘤实验证实CJ-2360能实现包括野生型和突变型在内的所有ALK阳性肿瘤的完全持久消退,这一结果要优于ceritinib,这些实验表明CJ-2360是一种有望用于晚期临床前研究的新型ALK抑制剂。
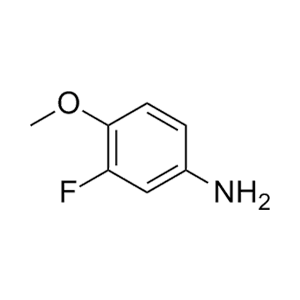
6、
合成ALK
-73、CJ-2349-2351和CJ-2356-2360
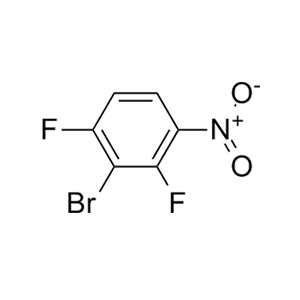
7、
合成CJ-2212和CJ-2224-2227
JianyongChen, Yunlong Zhou, Xuyuan Dong, Liu Liu, Longchuan Bai, DonnaMcEachern, Sally Przybranowski, Chao-Yie Yang, Jeanne Stuckey,Xiaoqin Li, Bo Wen, Ting Zhao, Siwei Sun, Duxin Sun, Lingling Jiao,Yu Jing, Ming Guo, Dajun Yang, and Shaomeng Wang Discovery of CJ-2360as a Potent and Orally Active Inhibitor of Anaplastic Lymphoma KinaseCapable of Achieving Complete Tumor Regression Journalof Medicinal Chemistry(2020),63(22),13994-14016.
注:文中图片均来源于参考文献
 技术支持
技术支持




 400-821-0725
400-821-0725



























 沪ICP备17019645号
沪ICP备17019645号







